

1月10日,南方医科大学黎孟枫及中山大学蔡俊超共合作在《PNAS 》上发表题为“ATOH8 binds SMAD3 to induce cellular senescence and prevent Ras-driven malignant transformation”的研究论文,研究表明了促衰老和TGF-β/SMAD3在突变ras驱动的衰老和肿瘤发生中的转化作用之间的重要相互作用。

https://www.pnas.org/doi/10.1073/pnas.2208927120
研究背景
基因突变导致的癌基因过度激活是正常细胞恶性转化为癌细胞的常见驱动力,如KRas突变。在培养的正常细胞中异位表达突变型Ras会诱导永久性和不可逆的生长停滞,称为癌基因诱导的衰老。OIS被证实为对恶性转化的内在防御,其特征是衰老相关的分泌表型(SASP)和永久性生长停滞,其中p38/p16和p53/p21蛋白已被确定为关键的启动子。
然而,单独或共同过表达这些启动子可以明显减缓细胞生长,但通常不足以导致衰老表型。SASP由多种细胞因子、生长因子和蛋白水解酶组成,可同时发挥抑癌和促癌作用。不过,目前还不清楚SASP是否以及是如何参与OIS向恶性转化。
研究发现
我们发现,在肺上皮细胞中癌基因Ras过度激活后,高水平转化生长因子β1 (TGF-β1)激活的SMAD3(而不是SMAD2或SMAD4)在诱导细胞衰老中起决定作用,独立于p53/p16/p15衰老途径。
重要的是,SMAD3结合一个潜在的肿瘤抑制因子ato8形成一个转录复合物,直接抑制一系列细胞周期促进基因,从而导致肺上皮细胞衰老。有趣的是,促生的SMAD3转化为致癌的,本质上促进了致癌ras驱动的恶性转化。
此外,Atoh8的耗尽会迅速加速Ras驱动的肺癌发生,而由Ras突变和Atoh8缺失驱动的肺癌(而不仅仅是Ras突变)对特定SMAD3抑制剂的治疗很敏感。另外,ato8基因的高甲基化可以在大约12%的临床肺癌病例中发现。
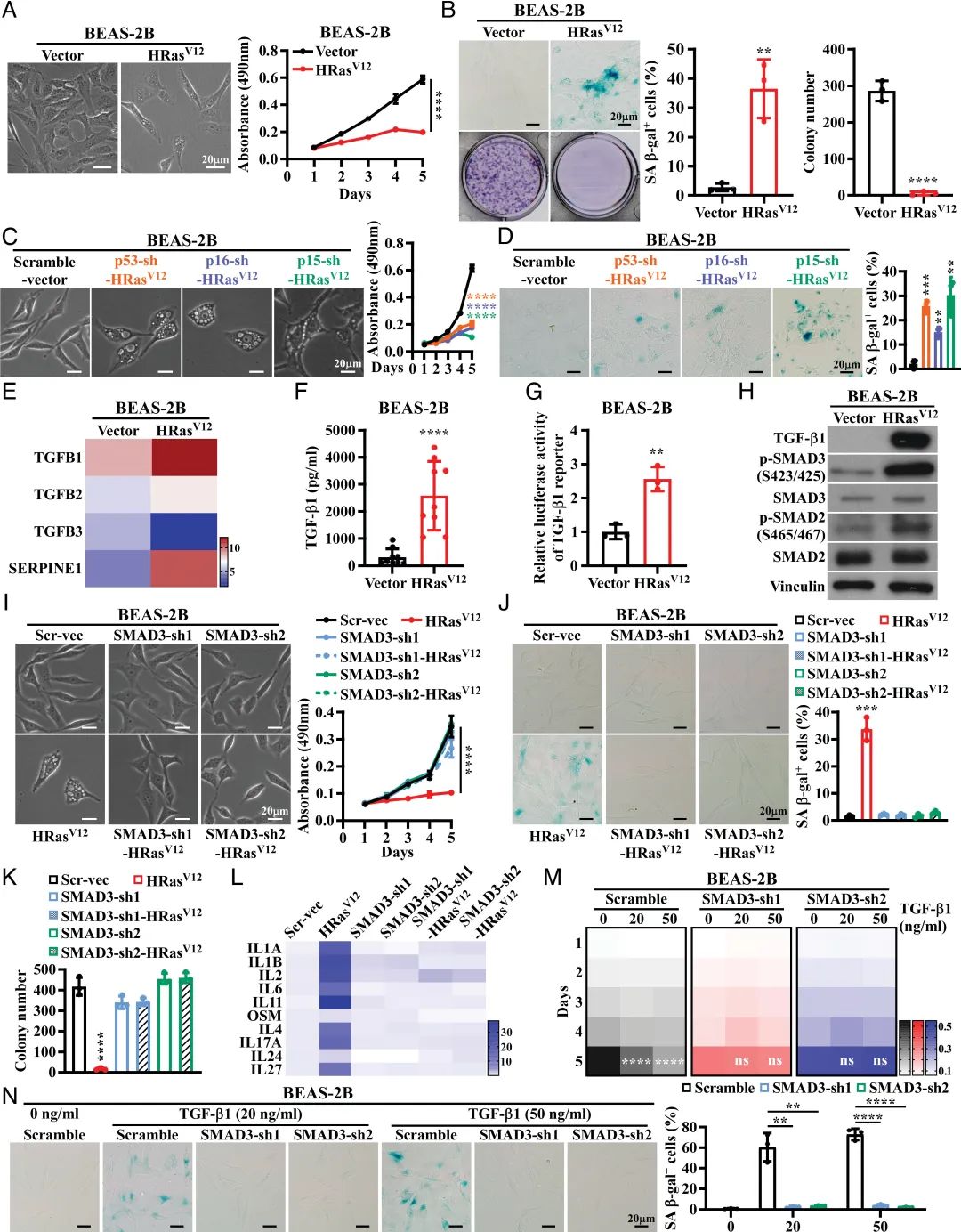
TGF-β1/SMAD3通路对RIS有重要作用
研究意义
总之,我们的研究结果不仅证明了上皮细胞的衰老是由潜在的肿瘤抑制控制的转录程序指导的,而且还证明了促衰老和TGF-β/SMAD3的转化效应之间的重要相互作用,这可能为开发早期检测和抗癌策略奠定了基础。(转化医学网360zhyx.com)
参考资料:
https://www.pnas.org/doi/10.1073/pnas.2208927120
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
摘自网址:http://www.360zhyx.com/home-research-index-rid-77590.shtml